Cộng hóa trị là gì
Liên kết cùng hóa trị là liên kết được hình thành giữa 2 ngulặng tử bởi 1 tuyệt nhiều cặp electron cần sử dụng phổ biến, link cùng hóa trị có 2 các loại là có cực hoặc không rất.
Bạn đang xem: Cộng hóa trị là gì
Vậy links cộng hóa trị có cực và không cực khác nhau cầm cố nào? chúng được hiện ra trong phân tử đối kháng hóa học và thích hợp hóa học như thế nào? Và làm sao để phân các loại liên kết hóa học theo độ âm điện, chúng ta thuộc khám phá qua bài bác này.
I. Sự sinh ra link cùng hóa trị
1. Liên kết cộng hóa trị xuất hiện thân các nguyên tử giống như nhau
* Sự ra đời đơn chất.
a) Sự sinh ra phân tử Hidro (H2).
- Hidro (H): 1s1 và Heli (He): 1s2
- Ngulặng tử H (Z=1) có thông số kỹ thuật electron là 1s1, hai nguyên tử H links với nhau bằng cách từng nguim tử H góp 1 electron tạo ra thành một cặp electron phổ biến vào phân tử H2. Nhỏng vậy trong phân tử H2, từng phân tử có 2 electron, như là cấu hình electron chắc chắn của khí hãn hữu heli:
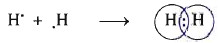
- Mỗi chnóng mặt kí hiệu ngulặng tố màn trình diễn một electron sinh sống lớp bên ngoài cùng.
- Ký hiệu H:H là bí quyết electron; H-H là cách làm kết cấu.
- Giữa 2 ngulặng tử Hidro có 1 cặp electron links biểu hiện bởi (-) sẽ là liên kết 1-1.
b) Sự sinh ra phân tử Nilớn (N2).
- Nilớn (N): 1s22s22p3 và Neon (Ne): 1s22s22p6
- Cấu hình electron nguyên ổn tử của N (Z=7) là 1s22s22p3, gồm 5 electron sống lớp ngoài cùng. Trong phân tử nitơ N2, nhằm đạt thông số kỹ thuật electron của nguyên ổn tử khí thảng hoặc sớm nhất Ne, mỗi nguyên ổn tử nitơ đề nghị góp phổ biến 3 electron.
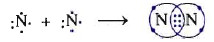
- Ký hiệu:NN: là công thức electron; N≡N là cách làm cấu tạo.
- Hai nguim tử N links cùng nhau bằng 3 cặp electron liên kết biểu thị bởi 3 gạch (≡), chính là links bố, link 3 bền hơn link song.
c) Liên kết cùng hóa trị là gì?
- Liên kết cùng hóa trị là liên kết được tạo nên giữa nhì nguyên tử bởi một tuyệt những cặp electron bình thường.
- Mỗi cặp electron bình thường làm cho 1 liên kết cộng hoá trị, đề nghị ta tất cả links 1-1 (vào phân tử H2), liên kết cha (trong phân tử N2).
* Liên kết cùng hóa trị ko phân cực:
- Là liên kết tạo nên từ 2 nguyên tử của thuộc 1 ngulặng tố (phân tử H2, N2 tất cả cùng độ âm điện), cho nên vì thế links trong những phân tử kia không phân cực. Đó là link cộng hoá trị không phân rất.

2. Liên kết cùng hóa trị xuất hiện thân các nguyên tử khác nhau
* Sự sinh ra thích hợp chất
a) Sự có mặt phân tử hidro clorua HCl
- Mỗi nguyên ổn tử H với Cl góp 1 electron sinh sản thành 1 cặp electron tầm thường nhằm chế tạo ra thành 1 links cùng hoá trị.
- Độ âm điện của clo là 3,16 lớn hơn độ âm năng lượng điện của hiđro là 2,20 buộc phải cặp electron liên kết bị lệch về phía clo, link cộng hóa trị này bị phân cực.
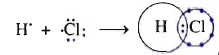
- Công thức cấu trúc H-Cl; Công thức electron H:Cl
* Liên kết cùng hóa trị có phân cực:
- Là liên kết cùng hóa trị trong số đó cặp electron phổ biến bị lệch về phía một ngulặng tử được Gọi là links cộng hóa trị bao gồm cực tuyệt links cộng hóa trị phân cực.
- Trong bí quyết electron của phân tử tất cả rất, người ta đặt cặp electron bình thường lệch về phía nguyên tử tất cả độ âm điện lớn hơn.
b) Sự xuất hiện phân tử Cacbon dioxit (Cacbonic) CO2
- Cấu hình electron nguim tử của C(Z=6) là 1s22s22p2, nguyên tử cacbon bao gồm 4 electron làm việc phần bên ngoài cùng.
- Cấu hình electron nguyên ổn tử của O(Z=8) là 1s22s22p4, nguyên tử oxi có 6 electron ở lớp ngoài thuộc.
- Trong phân tử CO2, nguim tử C nằm trong lòng 2 nguim tử O với góp thông thường với từng nguyên tử O hai electron. Mỗi nguyên tử O góp phổ biến với ngulặng tử C nhị electron tạo thành 2 link đôi.
- Ta tất cả O::C::O là công thức electron ; O=C=O là bí quyết cấu tạo.
- Như vậy, từng nguyên tử C hay O đều có 8 electron ở lớp bên ngoài thuộc, đạt thông số kỹ thuật bền bỉ của khí thi thoảng.
- Độ âm năng lượng điện của oxi (3,14) lớn hơn độ âm điện của C(2,55) bắt buộc cặp electron thông thường lệch về phía Oxi. Liên kết thân nhì ngulặng tử oxi với cacbon là phân cực, cơ mà phân tử CO2 tất cả cấu trúc trực tiếp nên 2 links song phân rất (C=O) triệt tiêu nhau, kết quả là phân tử CO2 không xẩy ra phân cực.
3. Tính chất của các chất tất cả liên kết cùng hóa trị
- Các hóa học nhưng mà phân tử chỉ có liên kết cùng hóa trị hoàn toàn có thể là hóa học rắn như đường, sulfur, iot,... có thể là chất lỏng: nước, ancol,... hoặc chất khí nhỏng khí cacbonic, clo, hiđro,...
- Các hóa học gồm rất nlỗi ancol etylic, mặt đường,... chảy các vào dung môi gồm cực nhỏng nước. Phần Khủng những chất không rất nlỗi iot, những chất cơ học không rất rã trong dung môi ko rất nlỗi benzen, cacbon tetraclorua,...
- Nói chung, những chất chỉ gồm links cùng hóa trị ko cực ko dẫn điện sinh sống mọi tâm lý.
II. Độ âm năng lượng điện với Liên kết hóa học
1. Quan hệ giữa link cùng hóa trị tất cả rất, links cộng hóa trị ko cực cùng link ion
- Trong phân tử, nếu cặp electron phổ biến chính giữa 2 nguyên ổn tử ta tất cả liên kết cộng hoá trị ko cực.
- Nếu cặp electron chung lệch về 1 phía của nguim tử (có giá trị độ âm điện to hơn) thì chính là link cùng hoá trị bao gồm cực.
- Nếu cặp electron phổ biến lệch hẳn về 1 nguyên tử, ta sẽ sở hữu links ion. Như vậy, links ion rất có thể coi là ngôi trường hợp riêng của link cộng hóa trị.
2. Hiệu độ âm năng lượng điện cùng liên kết hóa học
- Để nhận xét một số loại liên kết vào phân tử vừa lòng hóa học, fan ta hoàn toàn có thể phụ thuộc hiệu độ âm điện. Cách phân một số loại một phương pháp tương đối theo thang độ âm điện của Pau - Linc như sau:
| Hiệu độ âm điện | Liên kết |
| trường đoản cú 0 đến |
- Trong NaCl ta gồm hiệu độ âm điện: 3,16 – 0,93 = 2,23 > 1,7 link giữa Na cùng Cl là link ion.
- Trong phân tử HCl ta gồm hiệu độ âm điện: 3,16 – 2,2 = 0,96 ⇒ links giữa H với Cl là links cùng hoá trị tất cả rất.
- Trong phân tử H2 ta bao gồm hiệu độ âm điện: 2,đôi mươi – 2,đôi mươi = 0,0 ⇒ liên kết thân H với H là link cùng hoá trị không rất.
Xem thêm: Sân Đình - Chắn Pro Sân Đình
III. bài tập vận dụng links cùng hóa trị
* Bài 1 trang 64 SGK Hóa 10: Chọn câu đúng tốt nhất về link cùng hóa trị. Liên kết cùng hóa trị là liên kết
A. Giữa những phi klặng cùng nhau.
B. Trong đó cặp electron bình thường bị lệch về một nguim tử.
C. Được hình thành vày sự sử dụng bình thường electron của 2 ngulặng tử khác nhau.
D. Được tạo cho giữa 2 ngulặng tử bằng một giỏi các cặp electron tầm thường.
° Lời giải bài bác 1 trang 64 SGK Hóa 10:
- Đáp án đúng: D. Được khiến cho giữa 2 nguyên tử bằng một tốt nhiều cặp electron thông thường.
* Bài 2 trang 64 SGK Hóa 10: Chọn câu đúng trong các câu sau:
A. Trong link cộng hóa trị cặp electron lệch về phía ngulặng tử gồm độ âm điện nhỏ tuổi rộng.
B. Liên kết cộng hóa trị gồm rất được chế tạo thành giữa 2 nguim tử gồm hiệu độ âm năng lượng điện từ bỏ 0,4 mang đến nhỏ rộng 1,7.
C. Liên kết cộng hóa trị không tồn tại cực được khiến cho trường đoản cú các nguyên ổn tử khác hẳn nhau về đặc điểm hóa học.
D. Hiệu độ âm điện giữa 2 nguyên ổn tử bự thì phân tử phân cực yếu.
° Lời giải bài 2 trang 64 SGK Hóa 10:
- Đáp án đúng: B. Liên kết cộng hóa trị tất cả cực được tạo thành thành thân 2 nguim tử có hiệu độ âm năng lượng điện tự 0,4 cho bé dại hơn 1,7.
* Bài 3 trang 64 SGK Hóa 10: Độ âm năng lượng điện của một ngulặng tử đặc thù cho
A. Khả năng hút ít electron của ngulặng tử đó khi sinh ra liên kết chất hóa học.
B. Khả năng nhường electron của ngulặng tử đó mang đến ngulặng tử khác.
C. Khả năng tyêu thích gia phản nghịch ứng bạo gan tuyệt yếu đuối của nguyên tử đó.
D. Khả năng nhịn nhường proton của ngulặng tử đó đến nguyên tử khác.
Chọn lời giải đúng.
° Lời giải bài bác 3 trang 64 SGK Hóa 10:
- Đáp án đúng: A. Khả năng hút ít electron của nguyên tử đó Khi hình thành link hóa học.
* Bài 4 trang 64 SGK Hóa 10: Thế nào là links ion, liên kết cùng hóa trị ko rất, liên kết cùng hóa trị bao gồm rất, liên kết cộng hóa trị tất cả cực. Cho ví dụ minh họa.
° Lời giải bài bác 4 trang 64 SGK Hóa 10:
- Liên kết ion là links được có mặt vì chưng lực hút tĩnh điện thân các ion có năng lượng điện trái lốt. Thí dụ : K+ + Cl- → KCl.
- Liên kết cùng hóa trị ko cực là liên kết được khiến cho thân hai ngulặng tử bằng mọi cặp electron bình thường. Thí dụ: Cl. + .Cl → Cl:Cl
- Liên kết cùng hóa trị trong số đó cặp electron bình thường bị lệch về phía một ngulặng tử được hotline là liên kết cộng hóa trị gồm cực. Thí dụ: H. + .Cl → H :Cl hay H –Cl.
* Bài 5 trang 64 SGK Hóa 10: Dựa vào hiệu độ âm điện những nguyên ổn tố, hãy cho thấy gồm các loại links nào trong những chất sau đậy: AlCl3, CaCl2, CaS, Al2S3? (Lấy cực hiếm độ âm năng lượng điện của các nguyên tố ngơi nghỉ bảng 6 trang 45).
° Lời giải bài bác 5 trang 64 SGK Hóa 10:
- Hiệu độ âm điện:
CaCl2: 2,16. Liên kết ion
AlCl3: 1,55. Liên kết cùng hóa trị gồm cực
CaS: 1,58.Liên kết cộng hóa trị gồm rất.
Al2S3: 0,97. Liên kết cộng hóa trị tất cả rất.
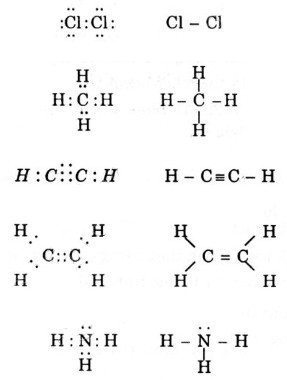
* Bài 6 trang 64 SGK Hóa 10: Viết phương pháp electron với công thức cấu tạo các phân tử sau: Cl2, CH4, C2H2, C2H4,NH4.
° Lời giải bài bác 6 trang 64 SGK Hóa 10:
- Công thức electron với bí quyết cấu tạo các phân tử sau:
* Bài 7 trang 64 SGK Hóa 10: X, A, Z là phần đa nguim tố gồm số năng lượng điện hạt nhân là 9, 19, 8.
a) Viết cấu hình electron nguyên ổn tử của các ngulặng tố đó.
b) Dự đoán links chất hóa học hoàn toàn có thể gồm giữa các cặp X cùng A, A cùng Z, Z cùng X.
° Lời giải bài 7 trang 64 SGK Hóa 10:
a) 9X : 1s22s22p5 Đây là F có độ âm năng lượng điện là 3,98.
19A : 1s22s22p63s23p64s1 Đây là K tất cả độ âm năng lượng điện là 0,82.
8Z: 1s22s22p4 Đây là O tất cả độ âm năng lượng điện là 3,44.
b) Cặp X và A, hiệu số độ âm năng lượng điện là: 3,98 – 0,82 = 3,16, có links ion.
- Cặp A cùng Z, hiệu số độ âm năng lượng điện là: 3,44 – 0,82 = 2,62, có link ion.
Xem thêm: Chức Vụ Chief Technology Officer Là Gì ? Giám Đốc Công Nghệ Là Ai
- Cặp X với Z, hiệu số độ âm điện là: 3,98 – 3,44 = 0,54, bao gồm link cộng hóa trị bao gồm rất.