Ion là gì hóa 10
Nguyên ổn tử kim loại và phi kyên ổn ước ao đạt đến cấu hình electron bền thì đề xuất thực hiện quá trình dường dìm electron, trở thành ion trái vệt liên kết nhau, hotline là liến kết ion.
Bạn đang xem: Ion là gì hóa 10
1. Tóm tắt lý thuyết
1.1.Sự tạo ra thành ion, cation, anion
1.2.Sự tạo thành thành links ion
1.3.Tinc thể ion
2. những bài tập minch hoạ
3. Luyện tập Bài 12 Hóa học tập 10
3.1. Trắc nghiệm
3.2. các bài luyện tập SGK với Nâng cao
4. Hỏi đáp vềBài 12 Cmùi hương 3 Hóa học tập 10

1.1.1. Ion, Cation, AnionSự chế tạo ra thành ion
Nguyên tử luôn luôn dung hòa về điện, nhưng mà Khi nguyên tử nhịn nhường xuất xắc dìm thêm electron thì nó vươn lên là phần tử sở hữu điện Gọi là ion.
Sự tạo ra thành Cationkhi ngulặng tử kim loại nhịn nhường đi e quanh đó thuộc thì biến thành ion dương (giỏi Cation).Các nguim tử kim loại phần bên ngoài thuộc có 1,2,3 electron → dễ nhường nhịn electron để tạo thành cation (ion dương) có thông số kỹ thuật chắc chắn của khí hãn hữu.
Hình 1:Sự hình thành ion Li+
Li→Li++ 1e
Cấu hình electron của Li: 1s22s1, Nguim tử Li dễ nhịn nhường 1 electron nghỉ ngơi phần ngoài cùng (1s22s1), phát triển thành ion dương Li+(1s2)Ví dụ:Na →Na++ 1e (cation Natri)
Mg→ Mg2++ 2e (cation Magie)
Al→ Al3++ 3e (cation Nhôm)
Kết luận:Trong các bội nghịch ứng chất hóa học, để đạt cấu hình electron bền của khí hi hữu ngulặng tử kim loại có định hướng dường e cho nguyên ổn tử nguim tố không giống nhằm vươn lên là ion dương, gọi là cation.
Tổng quát: M → Mn+ + ne
Sự chế tạo ra thành Cationkhi nguim tử phi klặng nhấn thêm electron thì biến thành ion âm (tuyệt Anion).Các ngulặng tử phi kim phần bên ngoài thuộc có 5,6,7e có khả năng nhấn thêm electron cùng biến thành anion (ion âm) bao gồm cấu hình bền chắc của khí hi hữu.
Hình 2:Sự xuất hiện ion F-
F + 1e→ F-
Cấu hình e của nguyên tử F : 1s2 2s2 2p5
Do có 7e phần bên ngoài thuộc phải Flo có xu hướng thừa nhận thêm 1e để đã có được thông số kỹ thuật bền bỉ của khí hãn hữu Ne

Hình 3:Sự ra đời ion Cl-
Cl + 1e→ Cl-
Ví dụ: O + 2e→O2-Các anion được hotline theo tên nơi bắt đầu axit (trừ oxi). F-(ion florua), Cl-(ion clorua) ...
Kết luận:
Trong các phản bội ứng chất hóa học, để đạt thông số kỹ thuật electron bền của khí hiếm nguim tử phi kyên bao gồm định hướng nhấn e từ ngulặng tử những ngulặng tố khác nhằm đổi mới ion âm, gọi là anion.
Xem thêm: Đeo Nhẫn Ngón Giữa Có Ý Nghĩa Gì ? Đeo Tay Trái Hay Phải? Ý Nghĩa Và Lưu Ý Khi Đeo Nhẫn Ngón Giữa
Tổng quát: A + ne → An-
1.1.2. Ion solo nguyên tử Và Ion Đa nguyên tửIon đối kháng ngulặng tửLà những ion khiến cho từ 1 ngulặng tử.Ví dụ: Cation: Na+, Ca2+… Anion: Cl- ,S2- …Ion đa nguyên ổn tửLà phần lớn nhóm nguim tử mang điện tích dương hay âm.Ví dụ: Cation: NH4+... Anion: SO42-, OH-…1.2. SỰ TẠO THÀNH LIÊN KẾT ION
Ví dụ: Xét phân tử NaCl
Ngulặng tử Na dường 1e mang lại nguim tử Cl để biến thành ion dương Na+.Na → Na+ + 1e
Mỗi ngulặng tử Cl nhấn 1e để biến thành ion âm Cl-Cl + 1e → Cl-
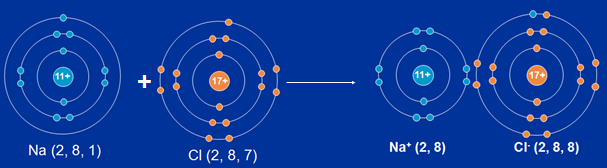
Hình 4:Quá trình hiện ra links ion giữa Natri cùng Clo
Liên kết ion là link được có mặt bởi vì lực hút tĩnh năng lượng điện thân các ion với điện trái lốt.Phản ứng hóa học:2Na + Cl2→ 2 NaCl1.3. TINH THỂ ION
1.3.1. Tinh thể NaCl
Ở thể rắn, NaCl trường thọ bên dưới dạng tinch thể. Trong mạng tinc thể NaCl các ion Na+,Cl- được phân bổ xoay rất nhiều đặn với gồm lẻ loi trường đoản cú bên trên các đỉnh của hình lập phương thơm bé dại. Xung xung quanh mỗi ion đều phải sở hữu 6 ion ngược dấu link cùng với nó.
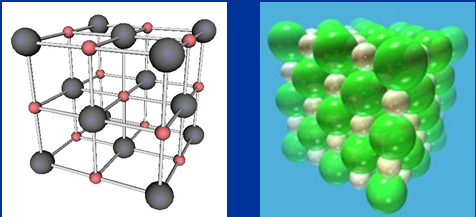
Hình 5:Tinch thể ion NaCl
1.3.2. Tính chất bình thường của thích hợp hóa học ionTinh thể ion rất bền bỉ vững bởi lực hút tĩnh điện thân những ion ngược lốt vào tinch thể lớn. Các vừa lòng hóa học ion số đông khá rắn, khó nóng tung, nặng nề cất cánh tương đối.Các hòa hợp chất ion thường xuyên rã những nội địa. Lúc nóng chảy, Lúc hòa tan trong nước bọn chúng tạo thành hỗn hợp dẫn được năng lượng điện, còn sinh sống tâm lý rắn thì không dẫn được điện.Xem thêm: 1️⃣ "Review" So Sánh Win 10 N Là Gì ? Windows 10 Pro N Là Gì
Bài 1:
Nguim tố X với Y ở trong đội A; nguyên ổn tử nguim tố X gồm 7 electron bên trên những phân lớp s, ngulặng tử nguyên ổn tố Y gồm 17 electron bên trên những phân lớp p. Công thức thích hợp chất tạo bởi X với Y; links hóa học trong thích hợp chất kia là:
Hướng dẫn:Nguyên tử ngulặng tố X tất cả 7 electron trên các phân lớp s⇒X: 1s22s23s24s25s1Vì trực thuộc nhóm A nên X trực thuộc team IANgulặng tử nguyên tố Y tất cả 17 electron trên những phân lớp p⇒Y: 2p63p64p5⇒4s24p5Vì Y thuộc team A⇒X ở trong team VIIA⇒Hợp chất XY: liên kết ion
Bài 2:Nguyên ổn tử nguyên tố X có electron cuối cùng thuộc phân lớp s, nguim tử nguim tố Y bao gồm electron sau cuối nằm trong phân lớp p. Biết rằng tổng số electron trong nguyên tử của X và Y là 20. Bản chất của liên kết hóa học vào vừa lòng hóa học X – Y là:
Hướng dẫn:X gồm e cuối thuộc phân lớp s ⇒ nhóm A (I hoặc II).Y tất cả e cuối thuộc phân lớp p⇒ team A (III → VIII).eX+ eY= 20⇒ pX+ pY= 20Ta có: X chỉ hoàn toàn có thể là: H (p = 1); He (p = 2); Na (p = 11) và K (p = 19).⇒ Ta thấy chỉ có Na (p = 11)⇒ pY= 9 (Flo) thỏa mãn nhu cầu.⇒ X - Y: NaF (link ion).